


近年来,人口老龄化加剧,慢性疾病、心血管疾病、癌症等患者数量持续攀升,对高效便捷治疗手段的需求愈发迫切。与此同时,材料、生物、人工智能等技术在医药领域广泛应用,加速了医疗器械与药品的融合,催生出众多疗效好、不良反应小、使用便捷的药械组合产品。这些产品打破了单一药品和器械的局限,成为医药行业创新的关键增长点。


本篇研究报告聚焦药械组合市场,深入探究中国、美国、欧洲和日本的药械组合产品定义及界定、细分市场分类,最终结合我国药械组合报批现状与政策趋势,为投资者提供参考建
议。
各国药械组合产品
定义及界定
中国
由药品(含生物制品)与医疗器械共同组成(物理混合、化学结合或其他方式组合为一体),并作为一个单一实体生产的医疗产品。以药品作用为主的药械组合产品,按药品申报注册;以医疗器械作用为主的药械组合产品,按医疗器械申报注册。
我国界定流程包含申请、初审、复审、结果查询四个阶段。国家药品监督管理局标管中心承担药械组合产品的属性界定工作,药品审评中心和器械审评中心承担药械组合产品的技术审评工作。
药审中心负责以药品作用为主的药械组合产品的注册申请;器审中心负责以器械作用为主的药械组合产品的注册申请。对于联合审评的药械组合产品,药审中心与器审中心协同开展申报产品的沟通咨询等工作,由牵头单位出具审评结论后转入国家药监局进行行政审批。
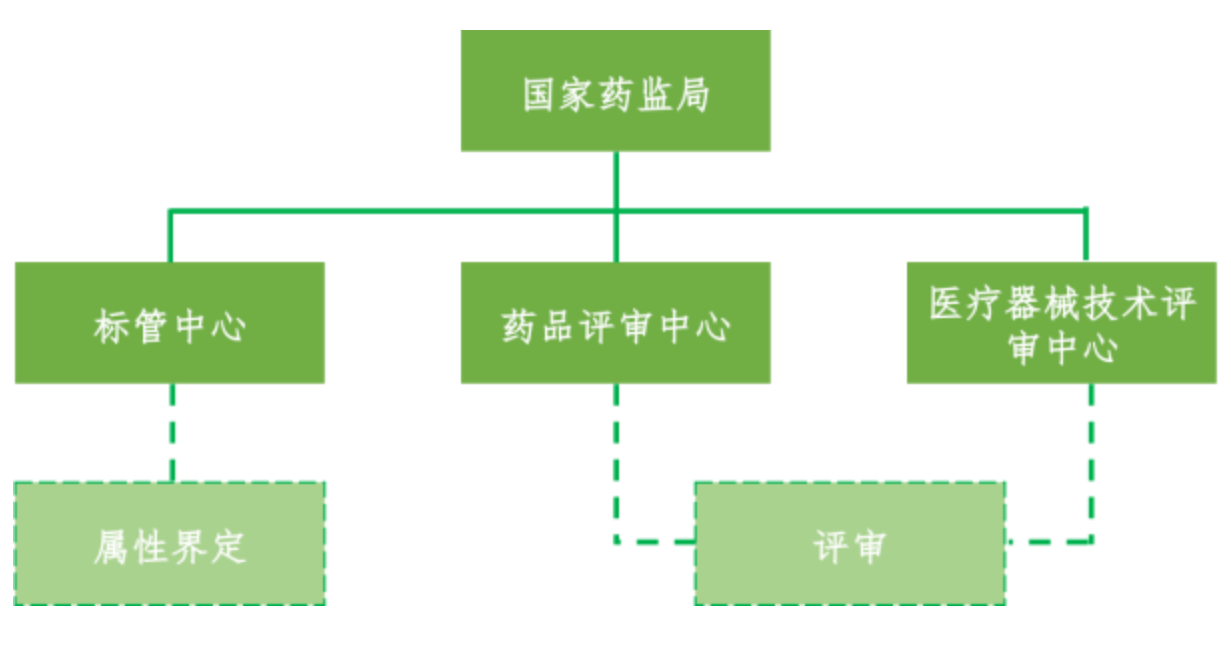
图1.中国药械组合监管架构(资料来源:公开信息,华医研究院整理)。
美国
包含两种或多种不同类型的受监管成分(药品、器械、生物制品),以单一实体形式、联合包装形式或交叉标签形式组合,共同实现主要预期用途的产品,共计3类:
1
单一实体组合产品:由药物、器械或生物制品通过物理或化学方式结合成一个实体(如药物洗脱支架);
2
联合包装组合产品:药品和器械分开包装但作为整体销售(如预充式注射器套装);
3
交叉标签组合产品:交叉标签组合产品包含两种类型
药物、器械或生物制品单独包装,根据其研究计划或拟议标签,仅用于与已批准的单独指定的药物、器械或生物制品一起使用,两者都需要实现预期用途、指示或效果,并且在拟议产品批准后,需要更改已批准产品的标签(例如,以反映预期用途、剂型、强度、给药途径或剂量的显著变化);
任何单独包装的试验药物、器械或生物制品,根据其拟议标签,仅用于与另一个单独指定的试验药物、器械或生物制品一起使用,两者都需要实现预期用途、指示或效果。
FDA对药械组合产品的界定流程为咨询、申请、初审与补正、正式审查及分类判定、复审流程。主作用(PMOA)来自药品,则该组合产品由药品审评和研究中心(CDER)或生物制品审评与研究中心(CBER)负责主审。PMOA来自器械,则由医疗器械和放射健康中心(CDRH)负责主审。
欧盟
将药械组合产品为以下几种类型:
1
药品起辅助作用的一体式药械组合产品;
2
药品起主要作用的一体式药械组合产品;
3
给药器械部分不可重复使用且专用于与药品组合一体上市的组合产品;
4
其他情况的给药器械组合(联用)。
与我国不同,欧盟注册实践中允许药品和给药器械组合包装、药品和给药器械的说明书交叉引用等非单一实体组合情形。
参与监管和评估的机构包括欧洲药品管理局(EMA)、欧盟委员会(EC)、负责管辖组合产品的药品部分的欧盟成员国国家主管机构(NCA)和组合产品医疗器械部分的主管机构(NB)。其中,EMA和NCA负责对药品进行评估,NB负责医疗器械的评估。
日本
已按照药品、医疗器械或者再生医疗等制品单独上市的药物、医疗器械或者再生医疗等制品,将其中两种及两种以上不同种类的产品组合成一种药品、医疗器械或者再生医疗等制品上市销售的产品。包括:
1
成套产品(构成组合产品的药物、医疗器械或者再生医疗等制品并非不可分割的单一实体,而是分别可独立流通的药品、医疗器械或再生医疗等制品),此类产品组合须有充分的临床必要性,否则不予批准。
2
集合产品(注射剂与溶剂等组合产品,包括未预先组装注射给药装置的单一容器中填充的药品、单独上市时不属于医疗器械的吸入用药品的容器等);
3
集合产品之外,与药物构成单一实体不可分割的医疗器械等不可单独上市的组合产品。
与我国不同,日本将非单一实体的药械组合也纳入定义中,并且药械组合的定义也适用于再生医疗等制品,即基因治疗、细胞治疗、组织工程产品等。
日本药械组合产品的监管部门为MHLW和PMDA(日本药品医疗器械综合机构)。MHLW制定和发布组合产品相关的法律法规,PMDA负责药械组合产品的注册审评,PMDA受MHLW管辖。PMDA既负责药品审评,也负责医疗器械审评,负责相关咨询、受理、审评以及开展相应检查。PMDA未专门设立组合产品的审评和评估机构,而是按照申请人拟定的类型(药品、医疗器械、再生医疗等制品)由PMDA下设的药品、医疗器械审评部门对应进行审评工作。对于非单一实体的组合情形,强调充分的临床必要性。
中国药械组合报批现状
及政策趋势分析
政策端
近年来,我国NMPA出台了一系列关于药械组合监管的规定,2023年7月发布《关于加强医疗器械分类界定系统和药械组合产品属性界定系统衔接的产品属性界定申报指南》,指导申请人正确选择申报系统和理解申报要求。具体归类方面,提出建议14类产品应纳入药械组合,其中尤其提出含药呼吸治疗产品、抗病毒鼻腔喷雾、皮肤创面保护敷料、含药远红外贴、含盐酸利多卡因的创面敷贴等新型贴剂及辅料应纳入药械组合。
同时,亦有不少专家学者提出应进一步明确药械组合属性界定的可预测性和统一性,适当拓展药械组合边界,根据给药途径、剂型、器械部分分类、无菌级别等综合判定药械组合的界定分类。在政策和专家的推动下,我国药械组合界定有望进一步拓展。
产品端
截至2023年3月1日,NMPA累计公布了339种企业申请界定的组合产品的最终界定结果,其中88种(占比26%)属于“以药品为主的药械组合产品”;78种(占比23%)为“以医疗器械为主的药械组合产品”;119种(占比35%)被界定为“不属于药械组合产品,应按药品申请注册”;25种(占比7%)被认定为“不属于药械组合产品,应按医疗器械申请注册”;17种(占比5%)为“不属于药械组合产品,应分别申报”。
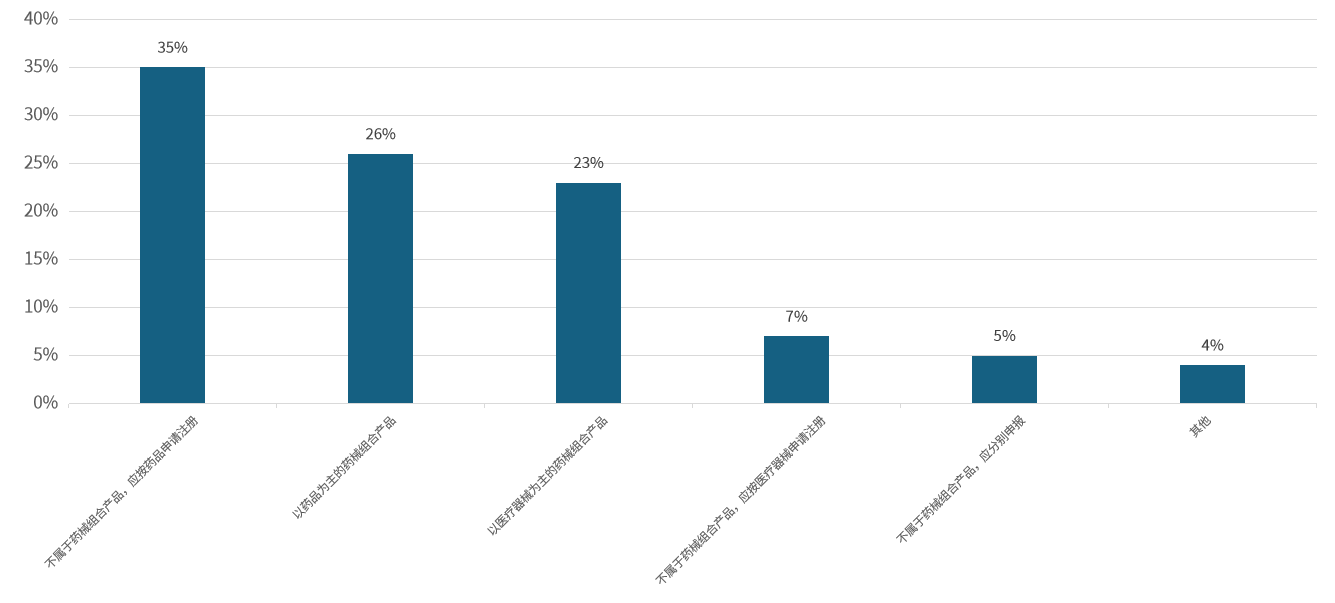
图2.截至2023年我国药械组合产品界定类目总览(资料来源:公开数据,华医研究院整理)。
在“以药品为主的药械组合产品”的88种产品里,占比前三的产品种类依次为含药功能型敷料(42%)、预填充注射器/笔(9%)和载药导管冲洗器(7%);“以医疗器械为主的药械组合产品”共78种,排名前三的是一次性使用医疗器械(21%)、含药功能型敷料类(19%)和其他类别产品(13%)。
对于某些产品是否属于药械组合产品,需结合具体情况进行个案判断。其划分的关键依据在于药品与器械之间是否存在高度的一体化设计与协同作用。例如,预填充注射器/注射笔中,若其器械部分的结构设计旨在配合药物特性,以实现更精准的给药效果,且药物与器械在使用过程中形成功能上的协同,则可认定为药械组合产品;反之,若药品与器械之间仅为物理组合,缺乏实质性互动或协同机制,则不纳入药械组合产品范围。

图3. 截至2023年以药品为主的药械组合产品(资料来源:公开数据,华医研究院整理)。
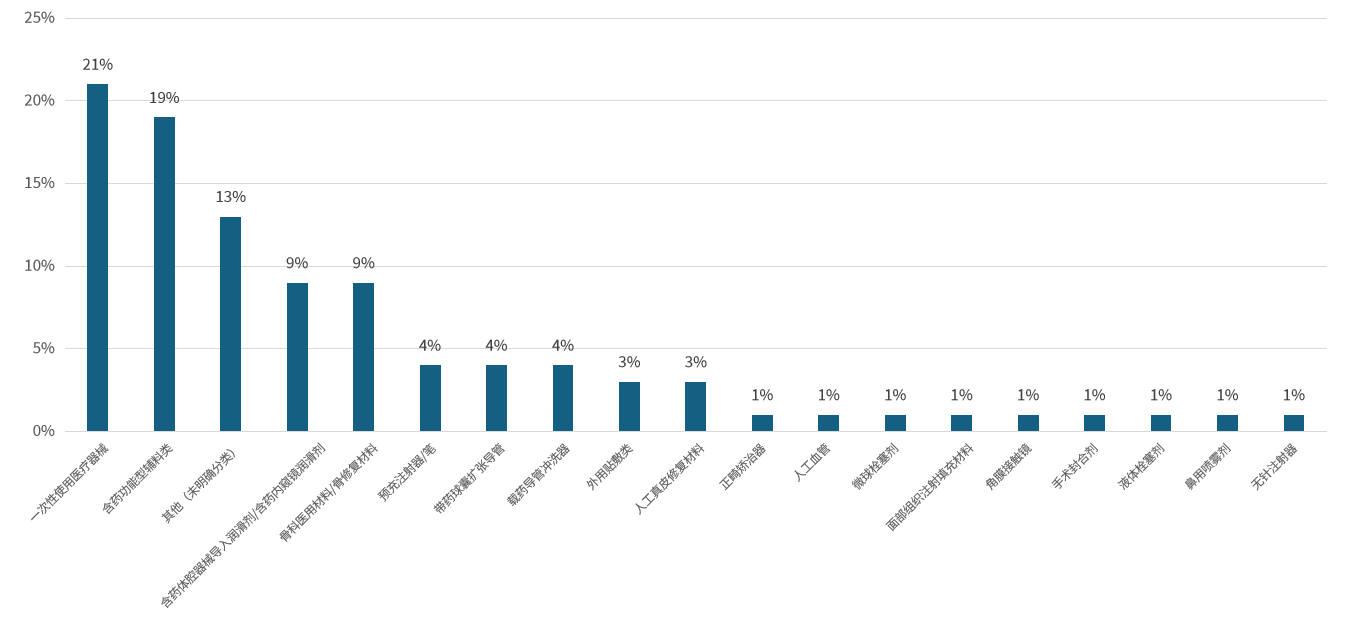
图4. 截至2023年以器械为主的药械组合产品(资料来源:公开数据,华医研究院整理)。
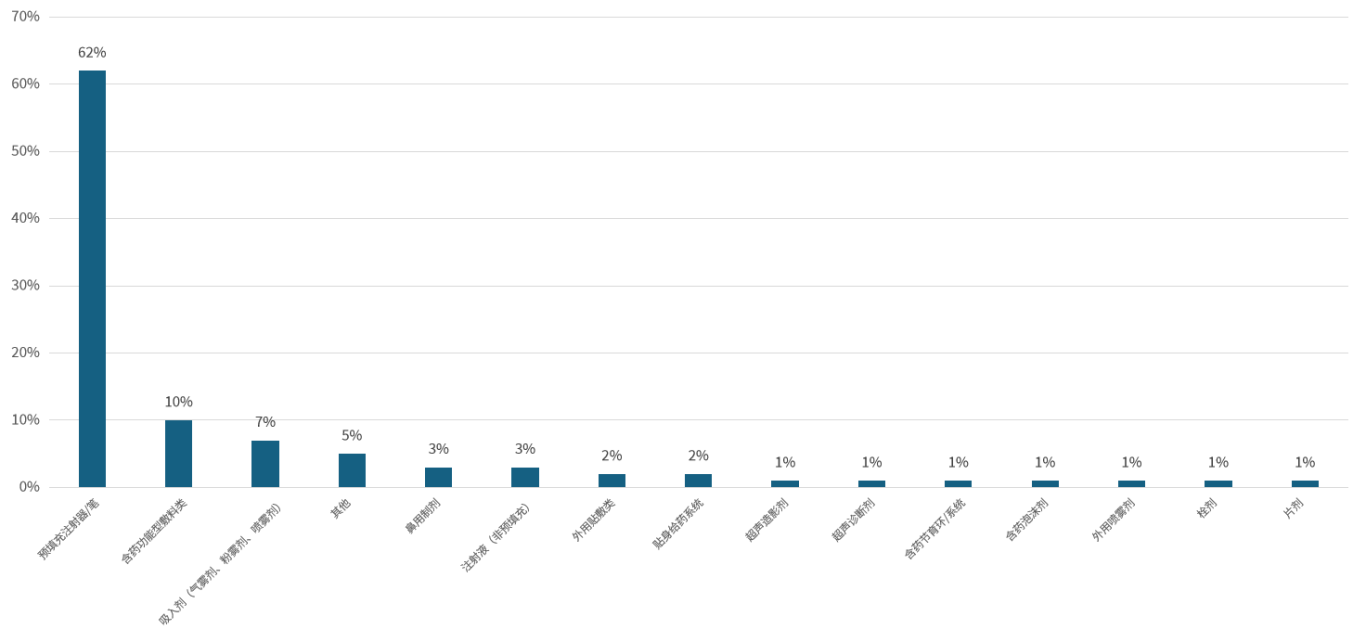
图5. 截至2023年不属于药械组合的产品(资料来源:公开数据,华医研究院整理)。
总结:
中国药械组合的未来
 在全球范围内,美国FDA对药械组合产品的分类界定最为清晰、系统,其监管体系具有高度的完整性与前瞻性。FDA依据组合产品的主要作用模式(Primary Mode of Action, PMOA)进行科学界定,并建立了包括单一实体组合产品、共包装组合产品及交叉标签组合产品在内的三大类监管路径,涵盖了当前国际主流的药械结合创新形式。这一制度设计使得透皮给药贴剂、药物洗脱支架/球囊、各类吸入剂装置、抗生素骨泥、预充注射器/笔、胰岛素泵等产品均可作为药械组合进行统一界定与监管,大大提高了监管的效率与产业发展的可预期性。因此,FDA的监管框架不仅在美国本土落地成熟,更在全球范围内发挥了重要的参考与引领作用。
在全球范围内,美国FDA对药械组合产品的分类界定最为清晰、系统,其监管体系具有高度的完整性与前瞻性。FDA依据组合产品的主要作用模式(Primary Mode of Action, PMOA)进行科学界定,并建立了包括单一实体组合产品、共包装组合产品及交叉标签组合产品在内的三大类监管路径,涵盖了当前国际主流的药械结合创新形式。这一制度设计使得透皮给药贴剂、药物洗脱支架/球囊、各类吸入剂装置、抗生素骨泥、预充注射器/笔、胰岛素泵等产品均可作为药械组合进行统一界定与监管,大大提高了监管的效率与产业发展的可预期性。因此,FDA的监管框架不仅在美国本土落地成熟,更在全球范围内发挥了重要的参考与引领作用。
相较而言,欧盟与日本虽未完全复刻FDA模式,但亦在分类体系上保持高度一致性。欧盟按照组合产品是否作为一体使用,以及主要作用是否由药品实现,将组合产品划分为四大类进行监管;日本则建立了三大类的组合产品分类体系,覆盖了与FDA相近的产品类型。这种对“药械融合产品”高度包容的界定模式,为鼓励相关技术路径创新提供了良好的制度保障。
与上述国家相比,中国当前的药械组合界定标准则相对较为审慎。根据国家药监局相关政策,药械组合产品需同时满足“药械一体化设计”和“主要作用来源于药品”两大前提条件,导致部分在FDA等国家明确作为药械组合产品管理的预充注射器/笔、吸入剂、透皮贴剂、胰岛素泵等,在中国尚未完全纳入药械组合产品的界定范围。这一差异,根本上源于中美两国在监管体系逻辑上的不同:中国在监管职能上仍以“药品”与“器械”条线分立管理为基础,组合产品更多作为两者的“附加判断”,缺乏类似美国OCP那样拥有协调权与制度设定权的统一管理机构,使得药械组合监管仍处于发展初期阶段。
不过,近年来,中国监管层已逐步认识到药械组合产品的产业价值与监管融合趋势,相关政策和分类工作正持续优化。例如,国家药监局标准管理中心(“标管中心”)在多个公开指南和分类建议中,已陆续将部分医美注射类产品(如含药玻尿酸)纳入药械组合产品路径,并鼓励企业在产品具备“强药械统一属性”时主动申报组合属性界定。这种“自下而上+监管指导”相结合的演进机制,释放出中国未来可能逐步拓展药械组合边界的积极信号。
从产业发展角度来看,像吸入制剂、透皮贴剂、智能注射装置等品类,具备典型的“药械协同互动性”和“统一性”,不仅市场空间广阔,且具有较强的技术门槛和临床依赖性,是未来监管放宽后最有望率先进入药械组合管理范畴的潜力赛道。随着监管体系日益与国际接轨,中国药械组合产品的界定与审批模式也有望朝着更加统一、高效的方向演进,为创新企业和资本市场带来更清晰的路径预期与制度红利。
研报收录征集
《华医研报》之《药械组合行业研究报告》企业火热收录中,欢迎相关企业及其他各方机构通过以下邮箱与我们联系:yiyuntech@huayifund.cn。
《华医研报》是由华医研究院倾力打造的医疗大健康产业各个细分赛道的深度研究报告。每一篇深度研究报告都对一个细分赛道进行全方位分析,从产业现状到产业未来,从技术路径到市场竞争,从全球标杆到国内龙头,以专业的视角和丰富的企业案例阐述华医对医疗大健康的独到见解。
银行、券商、投资人和产业人均是《华医研报》的忠实读者。自《华医研报》推出以来,受到产业各界的广泛好评。
声明


节选自华医研究院行业深度报告:2025年4月《药械组合行业研究报告》。
报告中的信息或所表达意见不构成投资、法律、会计或税务的最终操作建议。我公司不就报告中的内容对最终投资建议作出任何担保。

