引言
在脑肿瘤治疗史上,“完全缓解”几乎是一个奢侈的词。
而今年的 SITC 2025 大会上,一例来自 苏州大学附属第二医院 与 君赛生物 的病例数据,却打破了这一沉默——一位Ⅳ级脑胶质瘤(GBM)患者,在接受国产 GC101 TIL(肿瘤浸润淋巴细胞)治疗后,仅 4 周病灶清零,并持续缓解至今 超过 1.8 年。
这不是孤立的“奇迹”,而是一场围绕“免疫细胞能否跨越血脑屏障”的科学验证。
01|最凶险的脑瘤,为何被称作“冷肿瘤”?
胶质母细胞瘤(GBM)是神经系统最具侵袭性的原发恶性肿瘤。它生长快、复发早、对放化疗高度耐受——这使得患者的中位生存期仍停留在 6–10 个月,五年生存率不足 10%。 传统治疗方式的困境有三: 血脑屏障阻隔:多数药物与免疫细胞难以到达病灶; 免疫抑制环境:肿瘤分泌因子“麻醉”免疫系统; 高度异质性:每个病灶内抗原多变,单一靶点疗法难以奏效。 因此,脑胶质瘤被归为典型的 “免疫冷肿瘤”,即使 PD-1 抗体、CAR-T 等免疫手段屡试无功。在这样一个“无解战场”中,TIL(Tumor-Infiltrating Lymphocytes)疗法的出现,带来了突破口。 组织采集、TIL 制备到回输与随访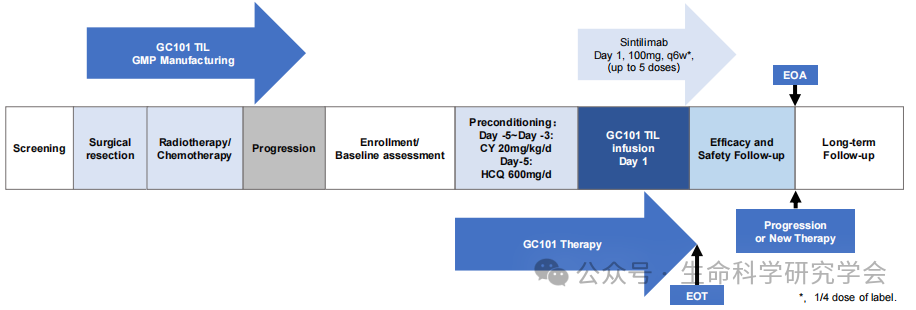
02|来自患者体内的“免疫种子”: GC101 的逆向策略
传统思路是在病情恶化后再尝试免疫治疗,而这次,研究团队反其道而行。在患者 首次手术(2023年1月5日) 时,便从肿瘤组织中分离、冷冻保存了 TIL “种子”。 与传统 TIL 方案不同,GC101 创新性地使用: 环磷酰胺(CY)+ 羟氯喹(HCQ)低剂量预处理; 单次静脉输注; 并联合抗 PD-1 抗体 信迪利单抗(Sintilimab)。 这一“轻负担式免疫策略”,显著减少了骨髓抑制与颅内副反应风险。 初治 → CAR-T → TIL 的完整时间轴 03|4 周清零、20 月未复发: 病例数据全解析
这些细胞原本就生活在肿瘤微环境中,拥有天然识别能力。基于君赛生物的 DeepTIL™ 平台,TIL 被扩增至 2.95×10¹⁰ 个细胞,其中 99.92% 为 T 细胞,CD8⁺ 比例高达 97.85%。团队采用“分段培养 + 冻存复苏”技术,保证了细胞的年轻性与活性。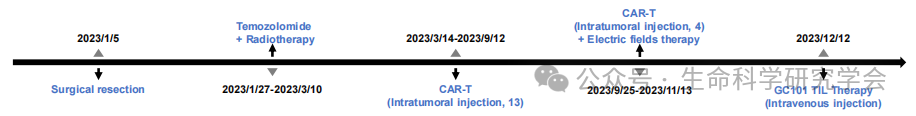
患者为 56 岁男性,左额叶 GBM(IDH 野生型、EGFR 扩增)。在经历放化疗 + CAR-T(累计 17 次,靶向 IL-13Rα2 与 B7-H3)仍进展后,于 2023年11月 入组 TIL 临床试验。 2023/12/12:TIL 输注(GC101) 基线 MRI:复发病灶最大径 2.8 cm 4 周后(2024/1/8):MRI 显示病灶完全消失 随访至 2025/10:持续完全缓解(CR),无新发灶 治疗前、4 周后、20 月后的对比 更令人关注的是: 这说明 TIL 不仅成功跨越血脑屏障,还在颅内形成了持久免疫监视。 04|“冷肿瘤”被点燃:科学意义与未来前景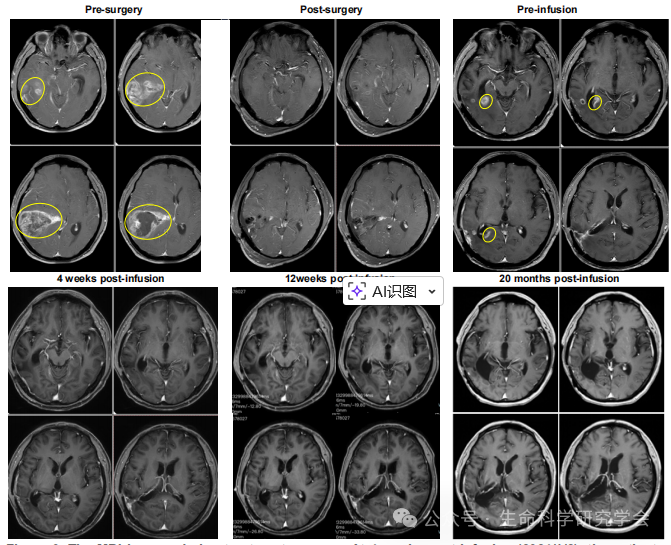
患者血象在输注后短暂下降,两周内恢复正常;外周血 CD4⁺/CD8⁺ 比例发生逆转,提示免疫反应重新激活。脑脊液(CSF)检测亦未发现恶性细胞。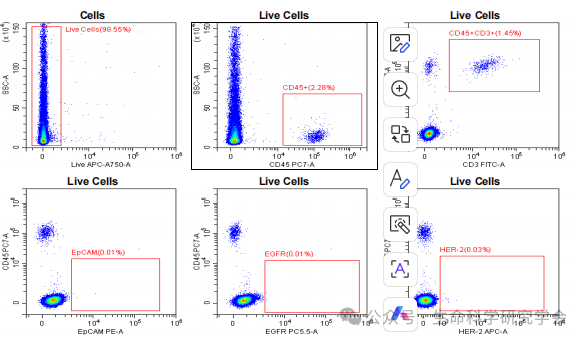
这例病例的重要性,不仅在于结果的罕见,更在于它传递了三层信号: 1️⃣ 免疫可及性验证 2️⃣ “早取材”策略的前瞻意义 3️⃣ 治疗安全性可控 在全球范围,TIL 技术正快速落地:2024 年,FDA 批准首个 TIL 药物 lifileucel(Amtagvi) 用于黑色素瘤,客观缓解率 31.5%,部分患者缓解超两年未复发 (NEJM, 2024)。 TIL 输注后外周血细胞恢复与免疫比值变化,免疫谱反转提示抗肿瘤反应启动
GBM 被认为免疫细胞“进不去”,但本例 TIL 静脉输注后仍在颅内起效,说明血脑屏障并非不可跨越。
TIL 来自初次手术组织,意味着患者越早留存高质量肿瘤样本,未来个体化免疫治疗机会越大。
本试验使用低剂量预处理方案,未见严重神经毒性,为 TIL 在脑瘤领域的推广积累安全经验。
如今,GC101 在复发脑胶质瘤中的表现,或将成为“冷肿瘤热化”的关键拐点。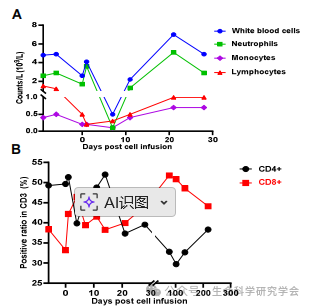
结语:科学让希望重新发声
过去十年,复发胶质母被认为是“医生尽力了”的终点。而这次苏大二院 & 君赛生物团队的 TIL 案例,让我们看到“自体免疫系统”也能在中枢神经系统打出漂亮一仗。 科学不是奇迹,但科学能让奇迹变得可复制。 当外科刀与药物的边界被免疫疗法重新定义, 这一次,免疫细胞真的“进了脑子”,而且打赢了。
或许“早取材、后免疫”的理念,
会成为未来脑肿瘤治疗的新常识。