
2025年7月3日,Cloudbreak Pharma Inc.(简称“拨康视云”,股票代码:02592.HK) 正式登陆港交所主板。作为国内首家通过量化模型精准锚定其投资价值的专业机构,我们有必要回到投资原点,从自身视角系统回顾当年的决策逻辑,并重新审视这个项目的价值判断与风险识别体系。
01
我们如何识别拨康视云?
2018年,国内的创新药投资陷入PD-1内卷,ADC尚未爆发。彼时,资本蜂拥进入肿瘤免疫治疗、大分子抗体和热门新靶点。而眼科因市场容量相对有限、缺乏明星产品,长期被主流资本忽视,形成了典型的“结构性低关注、高潜力”赛道。
华医通过医疗投资全景图量化分析,率先识别出眼科中的结构性机会:
致盲性眼科疾病诊疗渗透率高,但有效药物供给稀缺,大多为超适应症用药。
临床关注度高、患者就诊意愿强,具备真实支付意愿与可及性。
国内创新药布局稀少,尚无明确龙头,赛道格局待定。
当时估值水平明显低于同级肿瘤与罕见病领域,风险溢价可控,具备显著先发红利与估值修复空间。
这是一个典型具备“反共识”特征的结构性机会。
02
我们为何选择拨康视云?
在缺乏本土优质标的的背景下,华医通过全球量化筛选模型,系统性扩展项目池,最终在北美区域数据库中识别出拨康视云,并将其纳入“优先立项”名单。在多个核心维度上表现显著优于同类项目,具备稀缺的“穿越周期”特征:
未满足临床需求强度(翼状胬肉全球患病率超10%,中国潜在人群过千万)。
注册路径清晰(505(b)(2)路径,IIa期数据已验证安全性与有效性)。
团队背景稳健(由Allergan核心高管领衔,具备产品开发与全球注册经验)。
退出机制明确(可结构化的资本安排与多路径退出弹性)。
华医研究院的模型显示,拨康视云在“适应症潜力×技术差异化×团队成熟度”三维评分中位列全球眼科管线前15%,这一数据支撑了早期押注的决心。我们始终坚信:“真正的价值投资,不在于追逐热点,而在于量化评估未被定价的临床解决方案。”
图片来源:华医研究院
03
华医的角色,不只是资金
更是引入者、协同者
作为最早接触拨康视云的专业机构,我们不只是资金支持者,更是将其引入中国市场、协助完成落地架构与发展路径的深度参与者。
项目早期,在美国与团队多轮深度交流、实地尽调。
在国内落地过程中,推动项目组建中国子公司,并在结构、资源、战略方向上提出可行建议。
在即将IPO之际,我们仍在积极协助其与国内产业、渠道、潜在合作方建立联系。

图片来源:拨康视云招股说明书
04
眼科赛道的长坡厚雪
拨康视云的IPO是华医资本眼科布局的里程碑之一。在眼科这个“小科室”里,我们看到了可能改变数千万患者临床路径的潜力产品,也看到了一个由行业专家驱动、临床数据扎实、退出路径明确的项目。真正的投资价值,不是找到跟风的机会,而是发现被市场忽视的结构性空白,并用时间和专业,坚定陪跑。这就是我们最早押注拨康视云的原因,也是我们愿意一路陪伴它的底气。

图片来源:拨康视云港交所上市
拨康视云的IPO,是对我们量化评价投资判断的阶段性验证。七年前,华医资本通过量化模型在冷门赛道选中拨康视云;七年后,这一案例已成为医疗投资全景图中“眼科创新药”的标准样本。我们不会止步于此,而将继续保持“以资本之力,助医疗变革”的初心,助力更多真正有技术、有潜力的企业穿越周期,实现价值。
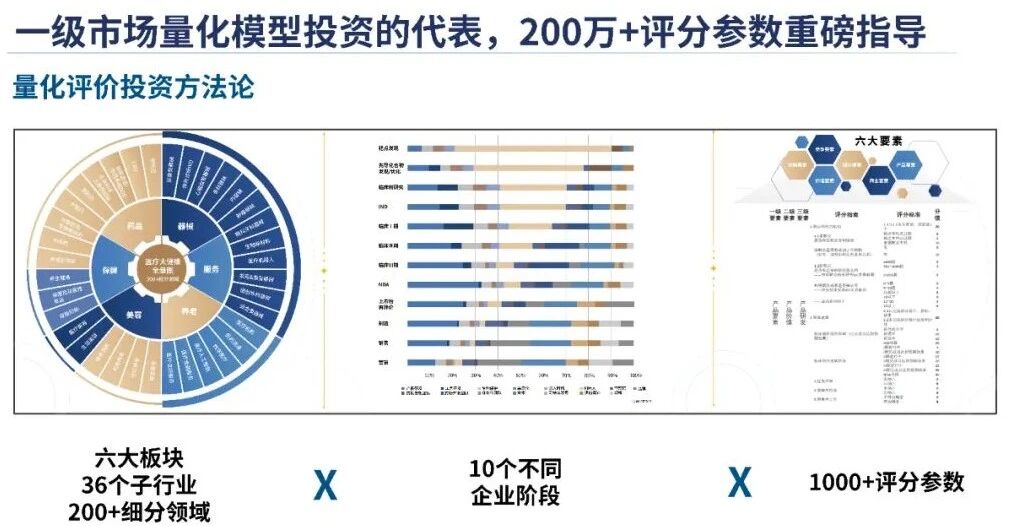
关于华医资本
华医资本是国内专注于一级市场医疗大健康产业量化评价投资的代表机构,目前已备案基金9个,管理规模近80亿。华医资本是研究驱动型投资机构,拥有国内唯一的医疗投资研究院-华医研究院,是国内医疗投资全景图的界定者。医耘科技为华医投后管理平台,致力于以量化模型对国内医疗大健康企业进行画像与评价。
关于拨康视云
拨康视云是一间临床阶段眼科生物科技公司,致力于开发各种疗法。眼科是研究眼部结构、功能和疾病的医学分支。公司首家主要营运实体Cloudbreak USA于2015年9月在美国注册成立及公司于2020年11月在开曼群岛注册成立。拨康视云拥有两款核心产品(CBT-001及CBT-009),均为自主开发。核心产品CBT-001适用于治疗翼状胬肉(一种良性增生性眼表疾病),已分别于2022年6月及2023年9月在美国及中国启动第3期多地区临床试验。核心产品CBT-009用于治疗青少年近视(5至19岁儿童及青少年近视),于2023年1月完成第1/2期临床试验,并于2024年7月向美国食品及药物管理局提交新药临床试验申请。公司其他候选药物处于相对早期开发阶段,包括两款临床阶段候选药物CBT-006及CBT-004,及四款临床前阶段候选药物CBT-007、CBT-199、CBT-145以及CBT-011。