引言
数字疗法产品目前被归类为一种医疗器械,对患者的病情确认、发展、预后等起着至关重要的作用。但是在审批的过程中,数字疗法其软件特性同传统器械有着极大的不同,作者认为目前套用传统医疗器械的审批流程是存在局限性,如果该行业能够如。
如何规范数字疗法的审批及认证,如何确立数字疗法的安全性和有效性,如何商业化落地并为患者带来收益的医疗产品是当今数字疗法在监管层面面临的三大挑战。本篇首先简单介绍了数字疗法产品在各国的监管机构和流程,其次以美国的数字疗法公司Pear Therapeutics为例,阐述当今数字疗法产品在审批和认证过程中存在的盲点。
1. 各国数字疗法的监管表
表:国外目前对数字疗法产品的监管机构和审批流程
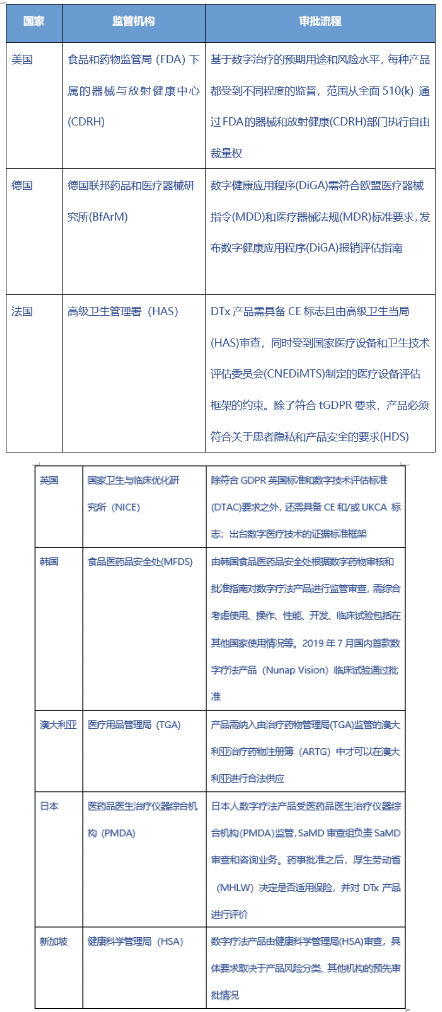
数据来源:华医研究院
中国的数字疗法的起步相对较晚,相关政策是在现行法规和标准体系以及当前认知水平下、并参考了国外法规与指南、国际标准与技术报告制定的。
现阶段国内还没有对数字疗法产品进行特定的监管或者颁布相关的指导原则,类似产品的监管和注册依照医疗器械软件的相关政策和流程进行审批。相关产品的监管和注册审批具体操作主要遵循《医疗器械软件注册技术审查指导原则》和《移动医疗器械注册技术审查指导原则》。
目前各国的监管部门对于数字疗法产品的审查基本都出于摸着石头过河的阶段,监管经验参照于之前的AI医疗等概念。我国的审批标准和流程相对于美国来说,周期更长更加保守,如果数字疗法产品能如预期般实现医疗服务的再升级,那么监管和审批流程必然针对数字疗法产品做出具体的审批流程和指导标准。
2. 数字疗法现存的监管盲点—以Pear为例
Pear Therapeutics主要面向一个专业症状提供基于算法的软件服务,需要依赖医生以处方形式开具治疗服务,但并没有健康管理师进行持续干预。截至2021年6月底,也就是距离reSET获批已经过了4年,Pear三款产品总计只开具了2万张处方,这意味着其至今仍未看到规模化的可能性。
虽然通过反向并购,Pear于2021年11月底实现上市,至2022年2月18日股价格几乎腰斩,2021年的销售额也仅仅只有400万美元如果不能解决其增长的瓶颈,其向投资人允诺的在2023年会有1.25亿美元收入的可能性并不存在。
图1:Pear股价图
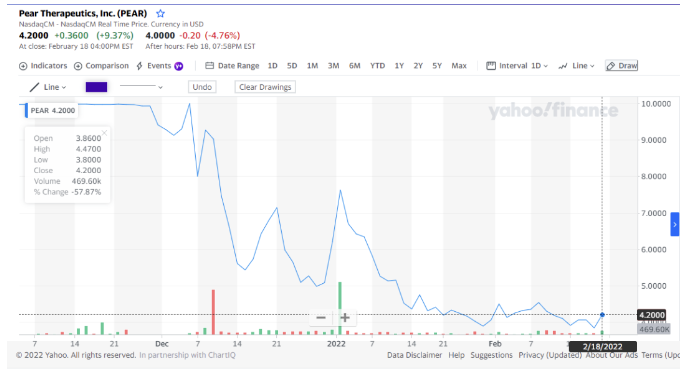
资料来源:Yahoo.finance
2020年12月,美国临床与经济评论研究所(Institute for Clinical and Economic Review,ICER)发布了一份针对三个阿片类药物使用障碍(Opioid Use Disorder,OUD)辅助治疗(Medication assisted treatment,MAT)软件的分析报告《Digital Health Technologies as an Adjunct to Medication Assisted Therapy for Opioid Use Disorder》。
根据该份报告,ICER的独立评估委员会确定当前证据不足以证明reSET-O的净健康益处,并且以当前价格计算的reSET-O代表较低的长期性价比。
与Pear的产品reSET-O相似的产品还有Connections (Chess Health)和DynamiCare (DynamiCare Health),这三款数字疗法产品在阿片类药物使用障碍的主要临床价值是试图实现客户留存,也就是尽量保证用户持续治疗而不是完成治疗。
而用户的长期留存,六个月到两年或更长时间,存在其它与戒断和对患者真正重要的因素,例如,就业、减轻经济压力、减少住院和急诊室就诊次数以及改善人际关系。
这三种数字疗法都没有直接的真实世界数据证据来证明数字疗法可以在多大程度上增强OUD患者的戒断或留存(关于有效性和真实世界数据的分析见“数字疗法行业的盲点——数据篇”)。
reSET-O是基于对相同审批模块的早期研究获得FDA批准的,但这些模块是在诊所的计算机上提供的,而不是通过智能手机应用程序提供的,而且应急管理的激励机制也根本不同,这也反映了目前FDA的监管体系不足以支撑数字疗法产品在迭代过程中的严肃监管。
由于Pear产品被批准与其实际使用场景完全不一致,ICER也对FDA进行批评并提出了明确的期望:“针对不同的风险水平和其他因素,FDA应制定明确的数字疗法分类法。
在具有代表性的不同患者群体内对数字疗法使用的安全性和有效性进行比较,FDA应该要求数字疗法公司对患者、临床医生、医疗集团和支付方提供明确足够有力的证据要求。”这一问题在2021年12月导致了Pear的产品面临被召回的风险。
就目前而言,以Pear为代表的此类院后处方类数字疗法产品(产品—医院—患者)的三个主要问题:首先,疗法的有效性受制于用户本身的生存、健康和经济状况,治疗不是唯一的决定因素。其次,数字疗法的实际价值很低或还没体现出来,需要提供扎实的证据才有说服力。
最后,监管过于粗糙,需要进行分层分类管理,而且需要在安全性和有效性上能提供能覆盖大规模群体的证据(RWE),而不是根据部分早期研究就进行审批。
从有效性来看,数字疗法难以像药品那样给出不受外部因素干扰的有效证据,其为了获取FDA批准而进行的试验都是设定了很多先决条件,如果这些条件出现一定的波动,哪怕是轻微的波动,实际结果就可能会出现很大的改变(实际上目前美国的前端DTx产品都可以在其实验设计和诊断流程中找到对本宣章的影子)。
比如用户的经济压力对其治疗起到了很大的作用,很多阿片患者没有稳定的工作,因此也缺乏费用或保险来覆盖治疗,无法维持治疗的费用,很容易就放弃治疗,而作为辅助治疗的数字疗法也就一起被放弃了。如果抛开这些条件不谈,只单纯的围绕着临床效果,就好比经济学的理性人假设一样,在现实世界是无法正常运行的,更不要说规模化。
其次,数字疗法的证据主要集中在临床,从reSET-O来看,即使是这方面的证据也不是非常有说服力。虽然数字疗法的实际使用场景一直在院外,但所有以处方形式发展的数字疗法公司都一直通过强调自身在院内的临床价值来和其他健康管理公司进行区分。作为一个院外的辅助治疗工具,数字疗法要说服用户必须要能提供明确的经济价值,而不仅是临床价值。
最后,作为药械行业的市场监管者,FDA对数字疗法的审批只是遵循了药物的审批流程,但并未意识到数字疗法虽然看似宽泛,可以针对某一个症状,但其无法像药品那样不受到患者外在的经济状况和心理状态的改变,而是随着患者生存、社交和心理等多重因素的变化和改变。
因此,如果仅限于一个小规模的试验就对数字疗法进行审批显然是不合适的(目前作者研究中发现临床实验的样本容量的区间多数集中在150—500)。
而且,由于不同经济状况、家庭、工作环境对数字疗法的疗效都可能产生显著的影响,监管需要对数字疗法做出更进一步的细分,以对其作出安全性和有效性的真实评估。
从处方类数字疗法的特征来看,由于在短期内无法突破只有临床价值而没有经济价值的框架(由于受制于患者自身的生存、健康和经济状况,临床价值依然存疑),其市场成熟期远未到来。
随着数字疗法的进一步发展,只有通过更大规模的试验和监管的细分指引,市场才能看到数字疗法是否具备真实的价值,或者只可能是一个永远无法成熟的局限于小规模的市场实验。
出品方:华医研究院
作者:杨晨屹
编者:李欣
LUCKY !
H
Y
医耘科技致力于以大数据提供医疗全产业链服务。公司的10C业务包括医疗健康产业市场营销服务、金融科技方案服务、产业咨询服务、品牌及商业运作等,致力于以大数据评价体系,助力企业全发展周期的成长和增值。旗下华医研究院是国内极少数一级市场医疗投资研究院,也是国内医疗投资全景图的界定者。专注医疗产业6大板块、36个子行业以及180+细分领域,拥有行业领先的企业成长性价值评价体系,经过多年的研究积累,研究院已拥有上万家大健康企业的经营数据,并长期保持互动,实时更新企业最新动态,已成为国内领先的医疗健康企业大数据研究机构,被业内人士称为医疗大健康领域的标准普尔。
微信扫一扫
关注该公众号